ZESTAW DO LECZENIA NIEWYDOLNOŚCI ŻYLNEJ, FLEBOGRIF
1. OPIS WYROBU
Zestaw do leczenia niewydolności żylnej, Flebogrif składa się z siedmiu elementów: kateteru, igły, prowadnika, koszulki introduktora, rozszerzacza, kranika trójdrożnego i strzykawek (Rys. 1.). Kateter wyposażony jest w elementy tnące składające się z pięciu wysuwanych, rozgałęziających się ramion rozmieszczonych obwodowo przeznaczonych do drapania wewnętrznej ściany żyły.
-
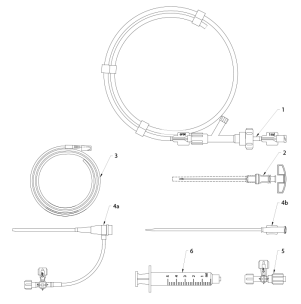
Rys. 1. Elementy zestawu do leczenia niewydolności żylnej Flebogrif
- Kateter Flebogrif 6 F
- Igła 18 G
- Prowadnik typu J 0.035”
- a. Koszulka introduktora 6, b. Rozszerzacz
- Kranik trójdrożny
- Strzykawka luer-lock 5 ml 2 szt.
-
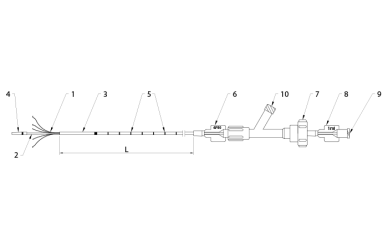
Rys. 2. Kateter Flebogrif
- Elementy tnące
- Część wewnętrzna
- Część zewnętrzna
- Miękka końcówka
- Znaczniki długości
- Informacja o rozmiarze
- Nakrętka zaciskowa (Y konektor)
- Nasadka części wewnętrznej z nadrukowaną informacją o objętości własnej kateteru
- Port do podawania sklerozantu (żeński łącznik luer-lock)
- Port do przepłukiwania (żeński łącznik luer-lock)
L – Długość robocza
Kateter składa się z dwóch współosiowo współpracujących części:
- wewnętrznej - służącej jako kanał dla prowadnika i do dostarczania spienionego sklerozantu. Część dystalna kateteru składa się z elementów tnących i atraumatycznej końcówki. Część proksymalna składa się z żeńskiego łącznika luer-lock informującego o objętości własnej kateteru oraz znacznika informującego o otwarciu / zamknięciu elementów tnących;
- zewnętrznej - posiadającej znaczniki długości co 1 cm (zaczynając 10 cm od końca dystalnego).
Elementy tnące są wysuwane poprzez przesuwanie zewnętrznej części po wewnętrznej. Zakręcenie nakrętki na Y konektorze umożliwia zablokowanie elementów tnących w pozycji otwartej.
Tabela 1. Parametry wyrobu
Średnica kateteru
6 F (2,08 mm)
Długości kateteru
60 cm; 90 cm
Objętość własna kateteru
0,8 ml dla katetera 60 cm
1 ml dla katetera 90 cm
Rozmiar igły
18 G
Długość igły
7 cm
Średnica prowadnika
0,035’’
Długość prowadnika
150 cm dla katetera 60 cm
180 cm dla katetera 90 cm
Pokrycie prowadnika
PTFE (politetrafluoroetylen)
Średnica koszulki introduktora z rozszerzaczem
6 F (minimum ID 2,18 mm)
Objętość strzykawki
5 ml
Typ strzykawki
luer-lock
2. DOSTĘPNE WERSJE WYROBU
Flebogrif jest dostępny w wersjach o długości 60 cm i 90 cm.
3. PRZEWIDZIANE ZASTOSOWANIE / WSKAZANIA
Zestaw do leczenia niewydolności żylnej, Flebogrif przeznaczony jest do mechaniczno-chemicznej ablacji żył powierzchownych kończyn dolnych.
3.1 PRZECIWSKAZANIA
Stosowanie kateteru Flebogrif jest na ogół przeciwwskazane w poniższych przypadkach:
- czynnej zakrzepicy żył głębokich i ich niedrożności;
- kobiet w ciąży;
- znacznego niedokrwienia kończyn dolnych;
- ciężkiego obrzęku limfatycznego (stopień 2 lub 3);
- zaburzenia krzepnięcia krwi;
- uczulenia lub nadwrażliwość na sklerozant i/oraz materiały, z których wykonano wyrób (poliamid, polietylen, stal nierdzewna);
- u pacjentów z przeciwwskazaniami do stosowania spienionego sklerozantu z innych przyczyn.
3.2 POTENCJALNE ZDARZENIA NIEPOŻĄDANE
Zdarzenia niepożądane, które mogą być związane z zastosowaniem tego wyrobu, obejmują (w kolejności alfabetycznej) ale nie są ograniczone do poniższych przypadków:
- ból;
- długotrwały ból;
- infekcja rany;
- krwawienie;
- krwiak;
- martwica skóry;
- nerwoból nerwu odpiszczelowego;
- perforacja naczynia;
- powikłania wynikające z zastosowania sklerozantu;
- przebarwienia;
- reakcje alergiczne lub nadwrażliwość na materiały, z których wykonano wyrób lub sklerozant;
- stwardnienie w przebiegu leczonej żyły;
- zakrzepica żył głębokich;
- zapalenie żył powierzchownych;
- zator.
Każdy poważny incydent związany z wyrobem należy zgłosić producentowi na adres reklamacje@balton.pl oraz właściwemu organowi kraju zamieszkania użytkownika i/lub pacjenta.
3.3 PROFIL UŻYTKOWNIKA
Przewidzianymi użytkownikami końcowymi tego wyrobu są wyłącznie lekarze posiadający odpowiednie przeszkolenie w zakresie zabiegów wewnątrzżylnych.
3.4 ŚRODOWISKO UŻYCIA
Stosowanie Flebogrifu jest dozwolone wyłącznie w salach operacyjnych / zabiegowych przystosowanych do zabiegów wewnątrzżylnych. Zasadniczym wymogiem jest dostępność ultrasonograficznego aparatu Duplex Doppler.
3.5 GRUPA DOCELOWA
Grupę docelową stanowią pacjenci wymagający ablacji pni powierzchownych żył kończyny dolnej (żyły odpiszczelowej i żyły odstrzałkowej). Żadne znane dane nie wskazują na istnienie ograniczeń co do stosowania wyrobu ze względu na płeć lub rasę.
Przed podjęciem decyzji o zastosowaniu kateteru Flebogrif potencjalne korzyści oraz zagrożenia związane z zastosowaniem wyrobu należy rozważyć indywidualnie dla każdego pacjenta.
4. OSTRZEŻENIA
- Ten wyrób jest przeznaczony do użytku jednorazowego wyłącznie u jednego pacjenta. Nie resterylizować i nie używać ponownie. Ponowne użycie lub resterylizacja może uszkodzić konstrukcję wyrobu i/lub spowodować jego nieprawidłowe działanie, mogące skutkować uszczerbkiem na zdrowiu lub zgonem. Ponowne użycie lub resterylizacja stwarza także zagrożenie kontaminacji wyrobu i infekcji, w tym transmisji chorób zakaźnych, co może prowadzić do uszczerbku na zdrowiu lub zgonu.
- Nie należy używać, jeżeli opakowanie zostało otwarte lub uszkodzone.
- Nie należy używać po terminie ważności podanym na etykiecie opakowania.
- Nie należy używać, jeżeli oznakowanie jest niekompletne lub nieczytelne.
- Nie należy wycofywać prowadnika w sposób mogący doprowadzić do kontaktu z zaostrzonym końcem igły – może to spowodować uszkodzenie lub odcięcie końca prowadnika.
- Nie wstrzykiwać sklerozantu przez port do przepłukiwania (Rys. 2. punkt 10. - Port do przepłukiwania (żeński łącznik luer-lock)
5. ŚRODKI OSTROŻNOŚCI
- Przed zabiegiem należy wykonać badanie ultrasonograficzne.
- Flebogrif należy przemieszczać wyłącznie po prowadniku.
- Zawsze należy potwierdzać poprawność umieszczenia Flebogrifu pod kontrolą ultrasonograficzną.
- Należy zamknąć elementy tnące przed wyjęciem Flebogrifu z ciała pacjenta.
- Ten wyrób jest przeznaczony do stosowania w żyle odpiszczelowej i odstrzałkowej.
- Należy potwierdzić prawidłowe położenie sekcji dystalnej Flebogrifu w połączeniu żyły powierzchownej i głębokiej (2 cm przed połączeniem) pod kontrolą ultrasonograficzną.
- W przypadku żył o średnicy większej niż 10÷12 mm należy rozważyć podwójne zadrapanie wewnętrznej ściany żyły (pierwsze przejście Flebogrifu po prowadniku – tylko zadrapanie; wstrzyknięcie piany podczas drugiego zadrapania).
- Należy ocenić pacjenta według Skali Żylnej Choroby Zakrzepowo-Zatorowej.
- Nie należy stosować nadmiernej siły podczas wprowadzania, manipulowania lub usuwania wyrobu. W przypadku pojawienia się oporu, sprawdź przyczynę jego wystąpienia przed podjęciem decyzji o kontynuowaniu zabiegu.
- Należy udzielić pacjentowi wszelkich informacji dotyczących zabiegu oraz prawidłowego postępowania w trakcie i po zabiegu.
6. SPOSÓB DOSTARCZANIA
6.1. ZAWARTOŚĆ OPAKOWANIA
Jeden (1) zestaw, w foremce ochronnej, pakowany w woreczek papier-folia, umieszczony wraz z Instrukcją Użycia w pudełku jednostkowym.
6.2. STERYLNOŚĆ
Wyrób jest dostarczany, wysterylizowany tlenkiem etylenu, w foremce ochronnej, pakowany w woreczek papier-folia. Jedynie zawartość woreczka należy uważać za sterylną. Wyrób pozostaje sterylny dopóki opakowanie to nie zostanie otwarte lub uszkodzone.
7. WARUNKI TRANSPORTU I PRZECHOWYWANIA
Przechowywać w temperaturze pokojowej, w suchym miejscu, w oryginalnym opakowaniu jednostkowym.
Nie przechowywać w temperaturze niższej niż 10 ºC i wyższej niż 30 ºC.
8. UTYLIZACJA
Zużyty wyrób należy traktować jako odpad medyczny. Po użyciu, usuń wyrób i jego opakowanie zgodnie z obwiązującymi procedurami ośrodka ochrony zdrowia i/lub miejscowymi przepisami.
9. GWARANCJA
Jeżeli dostarczony wyrób jest uszkodzony lub ma jakiekolwiek inne wady, należy poinformować o tym producenta i zachować wyrób oraz oryginalne opakowanie.
10. INSTRUKCJA DLA OPERATORA
Balton sp. z o.o. nie ponosi odpowiedzialności za celowe, przypadkowe lub wtórne szkody wynikające z niewłaściwego użytkowania tego produktu.
10.1 WYMAGANE WYROBY I MATERIAŁY
ILOŚĆ
WYRÓB / MATEIRAŁ
W miarę potrzeb
Sterylny roztwór soli fizjologicznej
W miarę potrzeb
Sklerozant
W miarę potrzeb
Skalpel
10.2 PRZYGOTOWANIE
- Sprawdź opakowanie bezpośrednie (woreczek papier-folia) pod kątem potencjalnych uszkodzeń oraz daty ważności.
W przypadku podejrzenia braku sterylności opakowania i/lub przekroczenia daty ważności, wyrobu nie wolno użyć.
- Otwórz woreczek papier-folia i otwórz foremkę ochronną.
- Sprawdź, czy żaden z elementów zestawu nie jest zgięty, splątany lub w inny sposób uszkodzony.
W przypadku podejrzenia jakiegokolwiek uszkodzenia, wyrobu nie wolno użyć.
- Sprawdź drożność oraz prześledź przebieg żyły powierzchownej wybranej do ablacji za pomocą sondy Duplex Doppler, ze szczególnym uwzględnieniem połączenia żyły powierzchownej i żyły głębokiej.
- Określ najniższy punkt niewydolnej żyły, do której zostanie wprowadzony kateter Flebogrif.
- Określ miejsce, w którym kateter Flebogrif będzie wprowadzany do żyły, dystalnie od odcinka ze stwierdzoną niewydolnością zastawek żylnych, a w przypadku niewydolności całej żyły, maksymalnie obwodowo, pamiętając o konieczności posiadania dostatecznej widoczności żyły w wizualizacji ultrasonograficznej w wybranym miejscu nakłucia.
Dodatkowo pomocne jest zlokalizowanie dużych gałęzi bocznych i miejsca odejścia bezpośrednich perforatorów.
- Ułóż pacjenta w pozycji leżącej na plecach do ablacji żyły odpiszczelowej lub w pozycji na brzuchu do ablacji żyły odstrzałkowej.
- Zdezynfekuj skórę pacjenta i obłóż sterylną serwetą.
- Wyjmij elementy zestawu z plastikowej foremki.
- Przepłucz igłę roztworem soli fizjologicznej i zdejmij osłonę.
- Przepłucz prowadnik w osłonie roztworem soli fizjologicznej.
- Zdejmij nasadkę ochronna z dystalnej części prowadnika.
- Wysuń lekko prowadnik z osłony.
- Przepłucz rozszerzacz i koszulkę introduktora roztworem soli fizjologicznej.
- Wprowadź rozszerzacz do koszulki introduktora przez zastawkę hemostatyczną i zatrzaśnij.
Rozszerzacz musi być zatrzaśnięty w zastawce hemostatycznej, aby uniknąć uszkodzenia naczynia.
- Wyjmij z osłony kateter i przepłucz oba jego porty roztworem soli fizjologicznej (Rys. 3.).
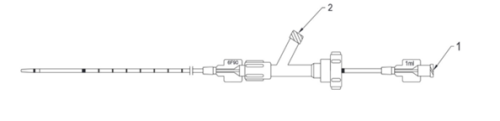
1. Port do podawania sklerozantu (żeński łącznik luer-lock)
2. Port do przepłukiwania (żeński łącznik luer-lock)
Rys. 3. Porty do przepłukania
10.3 PROCEDURA
Przeprowadź badanie ultrasonograficzne przed rozpoczęciem zabiegu.
- Wykonaj miejscowe znieczulenie skóry w wybranym miejscu nakłucia.
- Nakłuj żyłę igłą 18 G pod kontrolą ultrasonografii.
Nakłucie żyły igłą 18 G powinno zawsze odbywać się z zastosowaniem ultrasonografii.
- Rozprostuj końcówkę prowadnika i wprowadź prowadnik do igły.
- Usuń igłę.
- Wprowadzaj prowadnik aż do połączenia żyły powierzchownej i głębokiej (Rys. 4.).
Nie należy wprowadzać prowadnika do żyły głębokiej, aby zminimalizować możliwe ryzyko powikłań o charakterze zakrzepowym.
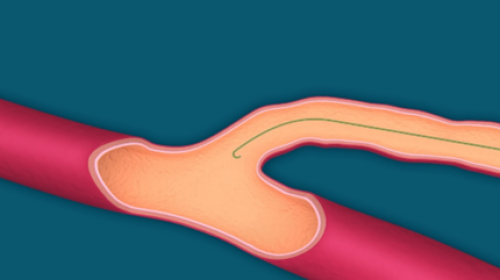
Rys. 4. Wprowadzanie prowadnika
- Nałóż koszulkę z zamontowanym rozszerzaczem na prowadnik.
- Wprowadź koszulkę z rozszerzaczem po prowadniku do nakłutej żyły.
Przed wprowadzeniem koszulki z rozszerzaczem można wykonać niewielkie nacięcie skóry skalpelem, co ułatwia jej wprowadzenie.
- Wycofaj rozszerzacz z koszulki.
- Wprowadź kateter Flebogrif przez koszulkę, po prowadniku przez cały odcinek żyły poddawanej ablacji, umieszczając jego końcówkę 2 cm poniżej połączenia żyły powierzchownej i głębokiej (Rys. 5.).
Zawsze wprowadzaj kateter Flebogrif po prowadniku.
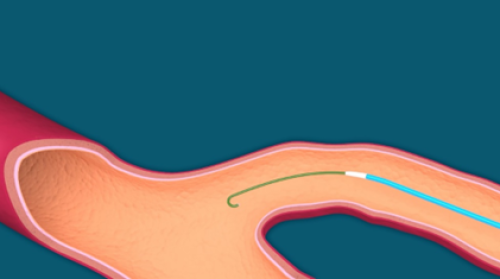
Rys. 5. Wprowadzanie kateteru po prowadniku
- Potwierdź prawidłowe położenie katetera Flebogrifu (2 cm poniżej połączenia żyły powierzchownej i głębokiej) z zastosowaniem ultrasonografii.
W przypadku konieczności zmiany pozycji katetera Flebogrifu, upewnij się, że elementy tnące są schowane. Zawsze zmieniaj położenie tylko po prowadniku.
- Usuń prowadnik.
- Odkręć nakrętkę zaciskową konektora Y (ruch przeciwny do ruchu wskazówek zegara) (Rys. 6.).
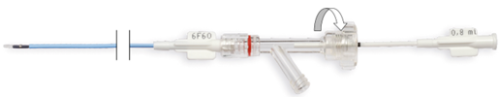
Rys. 6. Odkręcanie nakrętki zaciskowej konektora Y
- Unieruchom nasadkę (Rys. 2. punkt 8. – Nasadka części wewnętrznej z nadrukowaną informacją o objętości własnej kateteru.
- Drugą ręką przesuń do końca zewnętrzną część z konektorem Y (Rys. 7a.) po części wewnętrznej, w kierunku jej nasadki. Elementy tnące zostały otwarte (Rys. 7b.).
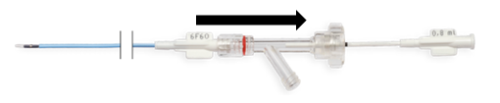
Rys. 7a. Przesuwanie konektora Y

Rys. 7b. Otwieranie elementów tnących
Na tym etapie elementy tnące są otwarte i dociskają do ściany żyły.
- Zakręć nakrętkę dociskową konektora Y (ruch zgodny z ruchem wskazówek zegara) (Fig. 8.).
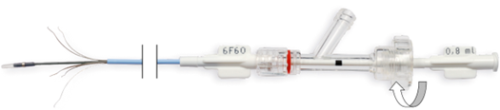
Rys. 8. Zakręcanie nakrętki zaciskowej konektora Y
- Zapoznaj się z instrukcją użycia sklerozantu.
Dawkę sklerozantu należy dobrać zgodnie z zaleceniami jego producenta.
Spień sklerozant bezpośrednio przed wstrzyknięciem. Zwróć uwagę na czas stabilności piany, według instrukcji użycia sklerozantu.
Stosunek powietrza lub CO2 do sklerozantu powinien wynosić 4:1 (4 części powietrza lub CO2 i 1 część sklerozantu).
- Przygotuj pianę:
- Zaaspiruj 1 ml sklerozantu do jednej strzykawki i 4 ml powietrza lub CO2 do drugiej strzykawki.
- Połącz obie strzykawki trójdrożnym kranikiem (Rys. 9.).
- Przetłaczaj mieszaninę gazu i sklerozantu tam i z powrotem między obiema strzykawkami, naprzemiennie naciskając ich tłoczki, aż utworzy się piana.
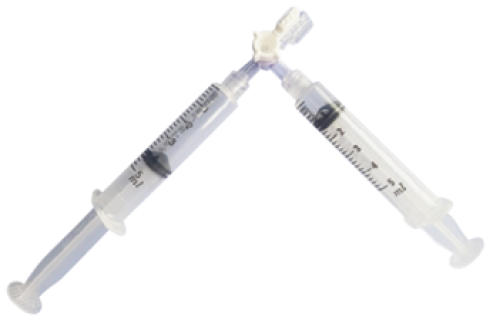
Rys. 9. Strzykawki połączone z kranikiem trójdrożnym
- Podłącz strzykawkę z przygotowaną dawką spienionego sklerozantu do nasadki katetera Flebogrifu (Rys. 2. punkt 9. – Port do podawania sklerozantu (żeński łącznik luer-lock).
Nie wstrzykuj sklerozantu przez port do przepłukiwania (Rys. 2. punkt 10. – Port do przepłukiwania (żeński łącznik luer-lock).
- Napełnij kanał kateteru Flebogrifu sklerozantem.
Objętość własna kateteru jest nadrukowana na nasadce – 0,8 ml dla wersji o długości 60 cm i 1,0 ml dla wersji o długości 90 cm (Rys. 10.).

Rys. 10. Oznaczenie objętości własnej kateteru
- Potwierdź położenie elementów tnących przy pomocy ultrasonografii.
Wstrzykując pianę uciskaj jednocześnie głowicą sondy ultrasonograficznej połączenie żyły powierzchownej i żyły głębokiej.
- Zacznij wyciągać kateter Flebogrif płynnym ruchem, drapiąc wewnętrzną ścianę żyły otwartymi elementami tnącymi, wstrzykując jednocześnie sklerozant (nie mniej niż 1 ml na każde 5 cm długości żyły).
Czynność tę należy kontynuować na całej długości odcinka żyły poddawanego ablacji, aż w żyle pozostanie ostatnie 10 cm katetera Flebogrif.
Jeżeli odcinek poddawany ablacji jest stosunkowo krótki, można wycofać koszulkę introduktora i kontynuować wyciąganie kateteru Flebogrifu z rozłożonymi elementami tnącymi jeszcze przez około 5 cm.
- Odkręć nakrętkę zaciskową konektora Y (ruch przeciwny do ruchu wskazówek zegara).
- Złóż elementy tnące, wyciągając część wewnętrzną z zewnętrznej, aż czarny znacznik pojawi się na zewnątrz konektora Y (Rys. 11.).
Nie ciągnij dalej za część wewnętrzną, po tym jak czarny znacznik pojawi się na zewnątrz konektora Y.

Rys. 11. Znacznik położenia elementów tnących (złożonych)
- Zakręć nakrętkę zaciskową konektora Y (ruch zgodny z ruchem wskazówek zegara).
- Przed wyjęciem kateteru Flebogrifu upewnij się, że elementy tnące są całkowicie złożone i zakończyłeś podawanie piany.
Czarny znacznik powinien być widoczny na zewnątrz konektora Y.
- Usuń kateter Flebogrif i koszulkę introduktora z żyły.
- Po zakończeniu zabiegu należy zastosować terapię uciskową elastyczną pończochą / bandażem uciskowym (przy 30-40 mmHg), przez co najmniej 2 tygodnie (zalecane).
11. BADANIA KLINICZNE
Badania kliniczne dla wyrobu są dostępne na stronie internetowej producenta.
GLOSARIUSZ SYMBOLI
-
Znak CE
-
Wyrób medyczny
-
Unikalny kod identyfikacyjny wyrobu
-
Wytwórca
-
Data produkcji
-
Użyć do
-
Numer katalogowy
-
Numer serii
-
Zapoznaj się z instrukcją użycia lub elektroniczną instrukcją użycia
-
Nie używaj, jeśli opakowanie jest uszkodzone oraz zapoznaj się z instrukcją użycia
-
Ostrzeżenie
-
Sterylizowane tlenkiem etylenu
-
Nie resterylizować
-
Nie używać ponownie
-
System pojedynczej bariery sterylnej
-
System pojedynczej bariery sterylnej z opakowaniem zewnętrznym
-
Niepirogenny
-
Chronić przed światłem słonecznym
-
Obchodzić się ostrożnie
-
Ograniczenie dopuszczalnych temperatur
-
Nie zawiera naturalnego lateksu kauczukowego
-
Informacja dodatkowa ułatwiająca właściwe użycie
-
n sztuk w opakowaniu
-
Przechowywać w suchym miejscu
-
Opakowanie nadające się do recyklingu
-
Średnica zewnętrzna kateteru
-
Długość kateteru
-
Rozmiar introduktora
-
Kompatybilność z prowadnikiem
-
Rozmiar igły
-
Objętość strzykawki
-
Szwajcarski Autoryzowany Przedstawiciel
1. OPIS WYROBU
Zestaw do leczenia niewydolności żylnej, Flebogrif składa się z siedmiu elementów: kateteru, igły, prowadnika, koszulki introduktora, rozszerzacza, kranika trójdrożnego i strzykawek (Rys. 1.). Kateter wyposażony jest w elementy tnące składające się z pięciu wysuwanych, rozgałęziających się ramion rozmieszczonych obwodowo przeznaczonych do drapania wewnętrznej ściany żyły.
-

Rys. 1. Elementy zestawu do leczenia niewydolności żylnej Flebogrif
- Kateter Flebogrif 6 F
- Igła 18 G
- Prowadnik typu J 0.035”
- a. Koszulka introduktora 6, b. Rozszerzacz
- Kranik trójdrożny
- Strzykawka luer-lock 5 ml 2 szt.
-

Rys. 2. Kateter Flebogrif
- Elementy tnące
- Część wewnętrzna
- Część zewnętrzna
- Miękka końcówka
- Znaczniki długości
- Informacja o rozmiarze
- Nakrętka zaciskowa (Y konektor)
- Nasadka części wewnętrznej z nadrukowaną informacją o objętości własnej kateteru
- Port do podawania sklerozantu (żeński łącznik luer-lock)
- Port do przepłukiwania (żeński łącznik luer-lock)
L – Długość robocza
Kateter składa się z dwóch współosiowo współpracujących części:
- wewnętrznej - służącej jako kanał dla prowadnika i do dostarczania spienionego sklerozantu. Część dystalna kateteru składa się z elementów tnących i atraumatycznej końcówki. Część proksymalna składa się z żeńskiego łącznika luer-lock informującego o objętości własnej kateteru oraz znacznika informującego o otwarciu / zamknięciu elementów tnących;
- zewnętrznej - posiadającej znaczniki długości co 1 cm (zaczynając 10 cm od końca dystalnego).
Elementy tnące są wysuwane poprzez przesuwanie zewnętrznej części po wewnętrznej. Zakręcenie nakrętki na Y konektorze umożliwia zablokowanie elementów tnących w pozycji otwartej.
Tabela 1. Parametry wyrobu
| Średnica kateteru | 6 F (2,08 mm) |
|---|---|
| Długości kateteru | 60 cm; 90 cm |
| Objętość własna kateteru | 0,8 ml dla katetera 60 cm 1 ml dla katetera 90 cm |
| Rozmiar igły | 18 G |
| Długość igły | 7 cm |
| Średnica prowadnika | 0,035’’ |
| Długość prowadnika | 150 cm dla katetera 60 cm 180 cm dla katetera 90 cm |
| Pokrycie prowadnika | PTFE (politetrafluoroetylen) |
| Średnica koszulki introduktora z rozszerzaczem | 6 F (minimum ID 2,18 mm) |
| Objętość strzykawki | 5 ml |
| Typ strzykawki | luer-lock |
2. DOSTĘPNE WERSJE WYROBU
Flebogrif jest dostępny w wersjach o długości 60 cm i 90 cm.
3. PRZEWIDZIANE ZASTOSOWANIE / WSKAZANIA
Zestaw do leczenia niewydolności żylnej, Flebogrif przeznaczony jest do mechaniczno-chemicznej ablacji żył powierzchownych kończyn dolnych.
3.1 PRZECIWSKAZANIA
Stosowanie kateteru Flebogrif jest na ogół przeciwwskazane w poniższych przypadkach:
- czynnej zakrzepicy żył głębokich i ich niedrożności;
- kobiet w ciąży;
- znacznego niedokrwienia kończyn dolnych;
- ciężkiego obrzęku limfatycznego (stopień 2 lub 3);
- zaburzenia krzepnięcia krwi;
- uczulenia lub nadwrażliwość na sklerozant i/oraz materiały, z których wykonano wyrób (poliamid, polietylen, stal nierdzewna);
- u pacjentów z przeciwwskazaniami do stosowania spienionego sklerozantu z innych przyczyn.
3.2 POTENCJALNE ZDARZENIA NIEPOŻĄDANE
Zdarzenia niepożądane, które mogą być związane z zastosowaniem tego wyrobu, obejmują (w kolejności alfabetycznej) ale nie są ograniczone do poniższych przypadków:
- ból;
- długotrwały ból;
- infekcja rany;
- krwawienie;
- krwiak;
- martwica skóry;
- nerwoból nerwu odpiszczelowego;
- perforacja naczynia;
- powikłania wynikające z zastosowania sklerozantu;
- przebarwienia;
- reakcje alergiczne lub nadwrażliwość na materiały, z których wykonano wyrób lub sklerozant;
- stwardnienie w przebiegu leczonej żyły;
- zakrzepica żył głębokich;
- zapalenie żył powierzchownych;
- zator.
Każdy poważny incydent związany z wyrobem należy zgłosić producentowi na adres reklamacje@balton.pl oraz właściwemu organowi kraju zamieszkania użytkownika i/lub pacjenta.
3.3 PROFIL UŻYTKOWNIKA
Przewidzianymi użytkownikami końcowymi tego wyrobu są wyłącznie lekarze posiadający odpowiednie przeszkolenie w zakresie zabiegów wewnątrzżylnych.
3.4 ŚRODOWISKO UŻYCIA
Stosowanie Flebogrifu jest dozwolone wyłącznie w salach operacyjnych / zabiegowych przystosowanych do zabiegów wewnątrzżylnych. Zasadniczym wymogiem jest dostępność ultrasonograficznego aparatu Duplex Doppler.
3.5 GRUPA DOCELOWA
Grupę docelową stanowią pacjenci wymagający ablacji pni powierzchownych żył kończyny dolnej (żyły odpiszczelowej i żyły odstrzałkowej). Żadne znane dane nie wskazują na istnienie ograniczeń co do stosowania wyrobu ze względu na płeć lub rasę.
Przed podjęciem decyzji o zastosowaniu kateteru Flebogrif potencjalne korzyści oraz zagrożenia związane z zastosowaniem wyrobu należy rozważyć indywidualnie dla każdego pacjenta.
4. OSTRZEŻENIA
- Ten wyrób jest przeznaczony do użytku jednorazowego wyłącznie u jednego pacjenta. Nie resterylizować i nie używać ponownie. Ponowne użycie lub resterylizacja może uszkodzić konstrukcję wyrobu i/lub spowodować jego nieprawidłowe działanie, mogące skutkować uszczerbkiem na zdrowiu lub zgonem. Ponowne użycie lub resterylizacja stwarza także zagrożenie kontaminacji wyrobu i infekcji, w tym transmisji chorób zakaźnych, co może prowadzić do uszczerbku na zdrowiu lub zgonu.
- Nie należy używać, jeżeli opakowanie zostało otwarte lub uszkodzone.
- Nie należy używać po terminie ważności podanym na etykiecie opakowania.
- Nie należy używać, jeżeli oznakowanie jest niekompletne lub nieczytelne.
- Nie należy wycofywać prowadnika w sposób mogący doprowadzić do kontaktu z zaostrzonym końcem igły – może to spowodować uszkodzenie lub odcięcie końca prowadnika.
- Nie wstrzykiwać sklerozantu przez port do przepłukiwania (Rys. 2. punkt 10. - Port do przepłukiwania (żeński łącznik luer-lock)
5. ŚRODKI OSTROŻNOŚCI
- Przed zabiegiem należy wykonać badanie ultrasonograficzne.
- Flebogrif należy przemieszczać wyłącznie po prowadniku.
- Zawsze należy potwierdzać poprawność umieszczenia Flebogrifu pod kontrolą ultrasonograficzną.
- Należy zamknąć elementy tnące przed wyjęciem Flebogrifu z ciała pacjenta.
- Ten wyrób jest przeznaczony do stosowania w żyle odpiszczelowej i odstrzałkowej.
- Należy potwierdzić prawidłowe położenie sekcji dystalnej Flebogrifu w połączeniu żyły powierzchownej i głębokiej (2 cm przed połączeniem) pod kontrolą ultrasonograficzną.
- W przypadku żył o średnicy większej niż 10÷12 mm należy rozważyć podwójne zadrapanie wewnętrznej ściany żyły (pierwsze przejście Flebogrifu po prowadniku – tylko zadrapanie; wstrzyknięcie piany podczas drugiego zadrapania).
- Należy ocenić pacjenta według Skali Żylnej Choroby Zakrzepowo-Zatorowej.
- Nie należy stosować nadmiernej siły podczas wprowadzania, manipulowania lub usuwania wyrobu. W przypadku pojawienia się oporu, sprawdź przyczynę jego wystąpienia przed podjęciem decyzji o kontynuowaniu zabiegu.
- Należy udzielić pacjentowi wszelkich informacji dotyczących zabiegu oraz prawidłowego postępowania w trakcie i po zabiegu.
6. SPOSÓB DOSTARCZANIA
6.1. ZAWARTOŚĆ OPAKOWANIA
Jeden (1) zestaw, w foremce ochronnej, pakowany w woreczek papier-folia, umieszczony wraz z Instrukcją Użycia w pudełku jednostkowym.
6.2. STERYLNOŚĆ
Wyrób jest dostarczany, wysterylizowany tlenkiem etylenu, w foremce ochronnej, pakowany w woreczek papier-folia. Jedynie zawartość woreczka należy uważać za sterylną. Wyrób pozostaje sterylny dopóki opakowanie to nie zostanie otwarte lub uszkodzone.
7. WARUNKI TRANSPORTU I PRZECHOWYWANIA
Przechowywać w temperaturze pokojowej, w suchym miejscu, w oryginalnym opakowaniu jednostkowym.
Nie przechowywać w temperaturze niższej niż 10 ºC i wyższej niż 30 ºC.
8. UTYLIZACJA
Zużyty wyrób należy traktować jako odpad medyczny. Po użyciu, usuń wyrób i jego opakowanie zgodnie z obwiązującymi procedurami ośrodka ochrony zdrowia i/lub miejscowymi przepisami.
9. GWARANCJA
Jeżeli dostarczony wyrób jest uszkodzony lub ma jakiekolwiek inne wady, należy poinformować o tym producenta i zachować wyrób oraz oryginalne opakowanie.
10. INSTRUKCJA DLA OPERATORA
Balton sp. z o.o. nie ponosi odpowiedzialności za celowe, przypadkowe lub wtórne szkody wynikające z niewłaściwego użytkowania tego produktu.
10.1 WYMAGANE WYROBY I MATERIAŁY
| ILOŚĆ | WYRÓB / MATEIRAŁ |
|---|---|
| W miarę potrzeb | Sterylny roztwór soli fizjologicznej |
| W miarę potrzeb | Sklerozant |
| W miarę potrzeb | Skalpel |
10.2 PRZYGOTOWANIE
- Sprawdź opakowanie bezpośrednie (woreczek papier-folia) pod kątem potencjalnych uszkodzeń oraz daty ważności.
- Otwórz woreczek papier-folia i otwórz foremkę ochronną.
- Sprawdź, czy żaden z elementów zestawu nie jest zgięty, splątany lub w inny sposób uszkodzony.
- Sprawdź drożność oraz prześledź przebieg żyły powierzchownej wybranej do ablacji za pomocą sondy Duplex Doppler, ze szczególnym uwzględnieniem połączenia żyły powierzchownej i żyły głębokiej.
- Określ najniższy punkt niewydolnej żyły, do której zostanie wprowadzony kateter Flebogrif.
- Określ miejsce, w którym kateter Flebogrif będzie wprowadzany do żyły, dystalnie od odcinka ze stwierdzoną niewydolnością zastawek żylnych, a w przypadku niewydolności całej żyły, maksymalnie obwodowo, pamiętając o konieczności posiadania dostatecznej widoczności żyły w wizualizacji ultrasonograficznej w wybranym miejscu nakłucia.
- Ułóż pacjenta w pozycji leżącej na plecach do ablacji żyły odpiszczelowej lub w pozycji na brzuchu do ablacji żyły odstrzałkowej.
- Zdezynfekuj skórę pacjenta i obłóż sterylną serwetą.
- Wyjmij elementy zestawu z plastikowej foremki.
- Przepłucz igłę roztworem soli fizjologicznej i zdejmij osłonę.
- Przepłucz prowadnik w osłonie roztworem soli fizjologicznej.
- Zdejmij nasadkę ochronna z dystalnej części prowadnika.
- Wysuń lekko prowadnik z osłony.
- Przepłucz rozszerzacz i koszulkę introduktora roztworem soli fizjologicznej.
- Wprowadź rozszerzacz do koszulki introduktora przez zastawkę hemostatyczną i zatrzaśnij.
- Wyjmij z osłony kateter i przepłucz oba jego porty roztworem soli fizjologicznej (Rys. 3.).

1. Port do podawania sklerozantu (żeński łącznik luer-lock)
2. Port do przepłukiwania (żeński łącznik luer-lock)
Rys. 3. Porty do przepłukania
10.3 PROCEDURA
- Wykonaj miejscowe znieczulenie skóry w wybranym miejscu nakłucia.
- Nakłuj żyłę igłą 18 G pod kontrolą ultrasonografii.
- Rozprostuj końcówkę prowadnika i wprowadź prowadnik do igły.
- Usuń igłę.
- Wprowadzaj prowadnik aż do połączenia żyły powierzchownej i głębokiej (Rys. 4.).

Rys. 4. Wprowadzanie prowadnika
- Nałóż koszulkę z zamontowanym rozszerzaczem na prowadnik.
- Wprowadź koszulkę z rozszerzaczem po prowadniku do nakłutej żyły.
- Wycofaj rozszerzacz z koszulki.
- Wprowadź kateter Flebogrif przez koszulkę, po prowadniku przez cały odcinek żyły poddawanej ablacji, umieszczając jego końcówkę 2 cm poniżej połączenia żyły powierzchownej i głębokiej (Rys. 5.).

Rys. 5. Wprowadzanie kateteru po prowadniku
- Potwierdź prawidłowe położenie katetera Flebogrifu (2 cm poniżej połączenia żyły powierzchownej i głębokiej) z zastosowaniem ultrasonografii.
- Usuń prowadnik.
- Odkręć nakrętkę zaciskową konektora Y (ruch przeciwny do ruchu wskazówek zegara) (Rys. 6.).

Rys. 6. Odkręcanie nakrętki zaciskowej konektora Y
- Unieruchom nasadkę (Rys. 2. punkt 8. – Nasadka części wewnętrznej z nadrukowaną informacją o objętości własnej kateteru.
- Drugą ręką przesuń do końca zewnętrzną część z konektorem Y (Rys. 7a.) po części wewnętrznej, w kierunku jej nasadki. Elementy tnące zostały otwarte (Rys. 7b.).

Rys. 7a. Przesuwanie konektora Y

Rys. 7b. Otwieranie elementów tnących
- Zakręć nakrętkę dociskową konektora Y (ruch zgodny z ruchem wskazówek zegara) (Fig. 8.).

Rys. 8. Zakręcanie nakrętki zaciskowej konektora Y
- Zapoznaj się z instrukcją użycia sklerozantu.
Dawkę sklerozantu należy dobrać zgodnie z zaleceniami jego producenta.
Spień sklerozant bezpośrednio przed wstrzyknięciem. Zwróć uwagę na czas stabilności piany, według instrukcji użycia sklerozantu.
Stosunek powietrza lub CO2 do sklerozantu powinien wynosić 4:1 (4 części powietrza lub CO2 i 1 część sklerozantu).
- Przygotuj pianę:
- Zaaspiruj 1 ml sklerozantu do jednej strzykawki i 4 ml powietrza lub CO2 do drugiej strzykawki.
- Połącz obie strzykawki trójdrożnym kranikiem (Rys. 9.).
- Przetłaczaj mieszaninę gazu i sklerozantu tam i z powrotem między obiema strzykawkami, naprzemiennie naciskając ich tłoczki, aż utworzy się piana.

Rys. 9. Strzykawki połączone z kranikiem trójdrożnym
- Podłącz strzykawkę z przygotowaną dawką spienionego sklerozantu do nasadki katetera Flebogrifu (Rys. 2. punkt 9. – Port do podawania sklerozantu (żeński łącznik luer-lock).
- Napełnij kanał kateteru Flebogrifu sklerozantem.

Rys. 10. Oznaczenie objętości własnej kateteru
- Potwierdź położenie elementów tnących przy pomocy ultrasonografii.
- Zacznij wyciągać kateter Flebogrif płynnym ruchem, drapiąc wewnętrzną ścianę żyły otwartymi elementami tnącymi, wstrzykując jednocześnie sklerozant (nie mniej niż 1 ml na każde 5 cm długości żyły).
Czynność tę należy kontynuować na całej długości odcinka żyły poddawanego ablacji, aż w żyle pozostanie ostatnie 10 cm katetera Flebogrif.
Jeżeli odcinek poddawany ablacji jest stosunkowo krótki, można wycofać koszulkę introduktora i kontynuować wyciąganie kateteru Flebogrifu z rozłożonymi elementami tnącymi jeszcze przez około 5 cm.
- Odkręć nakrętkę zaciskową konektora Y (ruch przeciwny do ruchu wskazówek zegara).
- Złóż elementy tnące, wyciągając część wewnętrzną z zewnętrznej, aż czarny znacznik pojawi się na zewnątrz konektora Y (Rys. 11.).

Rys. 11. Znacznik położenia elementów tnących (złożonych)
- Zakręć nakrętkę zaciskową konektora Y (ruch zgodny z ruchem wskazówek zegara).
- Przed wyjęciem kateteru Flebogrifu upewnij się, że elementy tnące są całkowicie złożone i zakończyłeś podawanie piany.
- Usuń kateter Flebogrif i koszulkę introduktora z żyły.
- Po zakończeniu zabiegu należy zastosować terapię uciskową elastyczną pończochą / bandażem uciskowym (przy 30-40 mmHg), przez co najmniej 2 tygodnie (zalecane).
11. BADANIA KLINICZNE
Badania kliniczne dla wyrobu są dostępne na stronie internetowej producenta.
GLOSARIUSZ SYMBOLI
-
Znak CE
-
Wyrób medyczny
-
Unikalny kod identyfikacyjny wyrobu
-
Wytwórca
-
Data produkcji
-
Użyć do
-
Numer katalogowy
-
Numer serii
-
Zapoznaj się z instrukcją użycia lub elektroniczną instrukcją użycia
-
Nie używaj, jeśli opakowanie jest uszkodzone oraz zapoznaj się z instrukcją użycia
-
Ostrzeżenie
-
Sterylizowane tlenkiem etylenu
-
Nie resterylizować
-
Nie używać ponownie
-
System pojedynczej bariery sterylnej
-
System pojedynczej bariery sterylnej z opakowaniem zewnętrznym
-
Niepirogenny
-
Chronić przed światłem słonecznym
-
Obchodzić się ostrożnie
-
Ograniczenie dopuszczalnych temperatur
-
Nie zawiera naturalnego lateksu kauczukowego
-
Informacja dodatkowa ułatwiająca właściwe użycie
-
n sztuk w opakowaniu
-
Przechowywać w suchym miejscu
-
Opakowanie nadające się do recyklingu
-
Średnica zewnętrzna kateteru
-
Długość kateteru
-
Rozmiar introduktora
-
Kompatybilność z prowadnikiem
-
Rozmiar igły
-
Objętość strzykawki
-
Szwajcarski Autoryzowany Przedstawiciel